
תוֹכֶן
בכדי לפשט את החישובים שלהם, כימאים יצרו יחידה סטנדרטית למספר האטומים של תרכובת מסוימת המעורבת בתגובה או בתהליך כימי אחר. הם מגדירים שומה אחת (מולקולה) ככמות של כל חומר שיש לו אותו מספר של יחידות יסוד כמו 12 גרם פחמן -12, שהוא מספר Avogadros (6.022 × 1023). מערכת המדידה של ה- SI (מטרי) מגדירה מילימול (ממול) כאלף השומה. בדרך כלל מחשבים את מספר השומות של חומר על ידי שקלול הכמות שברשותכם. אם ברצונך להמיר ל- Mmol, הכפל ב -103 (1,000).
TL; DR (יותר מדי זמן; לא קרא)
שומה אחת שווה למספר Avogadros של חלקיקים מתרכובת מסוימת. מילימול (מילול) הוא אלף של שומה.
כיצד לחשב שומות
מסות אטומיות נמדדות ביחידות של מסה אטומית (AMU). AMU אחד הוא בדיוק 1/12 ממסת הגרעין של אטום פחמן -12 במצב האדמה שלו. שומה אחת של חומר מוגדרת כשווה למספר Avogadros של חלקיקי אותו חומר. על פי הגדרה זו, משקלו של שומה אחת של חומר בגרמים זהה למספר המשקל של חלקיק בודד של אותו חומר ב- AMU. לדוגמה, המשקל האטומי של פחמן -12 הוא 12 AMU, כך ששומה אחת של פחמן -12 שוקלת 12 גרם.
שקול מיכל מלא גז מימן (H2). כל חלקיק במיכל הוא מולקולה המורכבת משני אטומי מימן, לכן עליכם לדעת רק את המסה האטומית של מימן כדי לחשב את המשקל המולקולרי. מרבית הגרסאות של הטבלה המחזורית מפרטות את המסה האטומית של כל יסוד תחת הסמל שלו. עבור מימן, שיש לו פרוטון בודד בגרעין שלו, 1.008 AMU שלו, שהוא ממוצע של כל האיזוטופים המתרחשים באופן טבעי של מימן. כתוצאה מכך, המסה האטומית של גז מימן היא 2.016 AMU, ושומה אחת של גז מימן שוקלת 2.016 גרם. כדי למצוא את מספר השומות במדגם שלך, היית שוקל את הדגימה בגרמים ומחלק את המשקל הזה במשקל המולקולרי של גז מימן בגרמים. לדוגמא, מדגם שמשקלו 15 גרם גז מימן טהור מכיל 7.44 שומות.
המרה לממול
לפעמים הכמויות הנחקרות כה קטנות, עד שהביטוי שלהם בשומות הוא מסורבל. הכנס למילימול. על ידי הכפלת מספר השומות באלף, אתה יכול להמיר מספר קטן מאוד למספר יותר לניהול. זה נוח במיוחד כשמדובר ביחידות נפח בסדר גודל של מיליליטר.
1 mol = 1,000 Mmol
ריכוז הפתרונות
כימאים משתמשים במולאריות כמדד לריכוז של תרכובת מסוימת בתמיסה. הם מגדירים את המולאריות כמספר השומות לליטר. אתה ממיר מולקולריות למילימולאריות על ידי הכפלת 1,000. לדוגמא, תמיסה של 1 מולקולה (טוחנת, כתוב גם כ- M) יש ריכוז של 1 מול לליטר. זה שווה ערך לתמיסה של 1,000 מ"מ (מילימולאר, לפעמים גם כתוב כ- mM), שהיא כזו שמכילה 1,000 מ"מ לליטר.
דוגמא
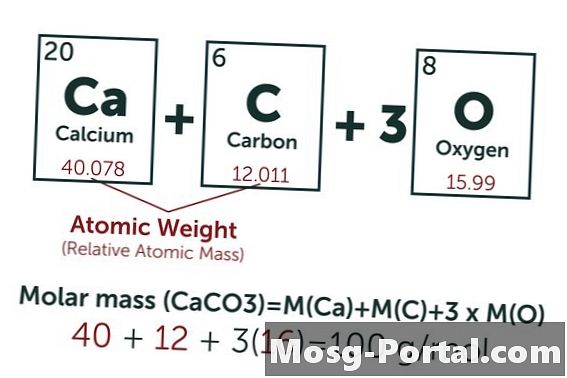
תמיסה מכילה 0.15 גרם סידן פחמתי. כמה מילימול זה?
הנוסחה הכימית של סידן פחמתי היא CaCO3. המשקל האטומי של הפחמן (C) הוא בערך 12 אמ"ו, זה של החמצן (O) בערך 16 אמ"ו ומשקל הסידן (Ca) הוא כ- 40 אמאו. כל מולקולה של סידן פחמתי שוקלת אם כן 100 AMU, כלומר שומה אחת שוקלת כמאה גרם. משקל של 0.15 גרם מייצג 0.15 גרם ÷ 100 גרם / מול = 0.0015 שומות. זה שווה ל 1.5 מילול.
מה המולאריות והמילימולריות של הרבה סידן פחמתי זה ב 2.5 ליטר תמיסה?
המולאריות מוגדרת כמספר השומות לליטר, לכן חלקו את מספר השומות ב -2.5 כדי לקבל את המולאריות: 0.0015 ÷ 2.5 =
0.0006 מ '
הכפל ב -1,000 כדי לקבל את המילימולריות =
0.6 מ''מ
שימו לב כי אתם מגיעים לאותה התוצאה למילימולאריות אם תחלקו את מספר המילימול בנפח הפתרון.