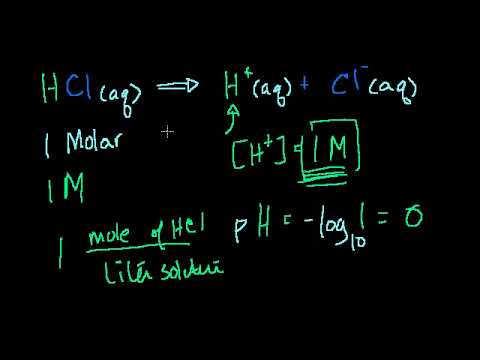
כשאתה מתאר עד כמה פיתרון חומצי או בסיסי, אתה מתאר את הריכוז של שני היונים שלו. הראשון, הידרוניום (H3O +), נוצר כאשר יון מימן מהמים או המומס מתחבר למולקולת מים. השני, הידרוקסיד (OH-), נוצר כאשר מומס מתנתק להידרוקסיד או כאשר מולקולת מים מאבדת יון מימן. PH של פתרונות מתאר הן את ההידרוניום והן את ריכוז ההידרוקסיד באמצעות סולם לוגריתמי.
הכפלו את הפתרונות pH ב- -1. לדוגמא, דמיין פיתרון עם pH של 3.3--3.3 x -1 = -3.3.
הרם 10 לכוח התוצאה - 10 ^ -3.3 = 0.00050118723, או בערך 5 x 10 ^ -4. זהו ריכוז יוני ההידרוניום, הנמדד בשומות לליטר.
חיסור 14 מה- pH - 3.3 - 14 = -10.7.
הרם 10 לתוצאה - 10 ^ -10.7 = 1.995 x 10 ^ -11, או בערך 2.0 x 10 ^ -11. זהו ריכוז ההידרוקסיד בתמיסה, שנמדד בשומות לליטר.