תוֹכֶן
על מנת להמיס מוצק לתמיסה, יש לשבור קשרים מולקולריים. לסוכרים, שהם מוצקים מולקולריים, יש כוחות בין-מולקולריים חלשים המחברים אותם זה לזה. מלחים, לעומת זאת, הם מוצקים יוניים ויש להם כוחות חזקים בהרבה בגלל היונים הקוטביים שלהם (מגנטים) השומרים אותם יחד. דרוש אנרגיה רבה יותר בכדי לפרק מולקולות מלח מכפי שהיא מכילה סוכר ולהבדילם נדרש החלפת מולקולות. במילים פשוטות, אין פתרונות אחרים מלבד מים שיפזרו מלח.
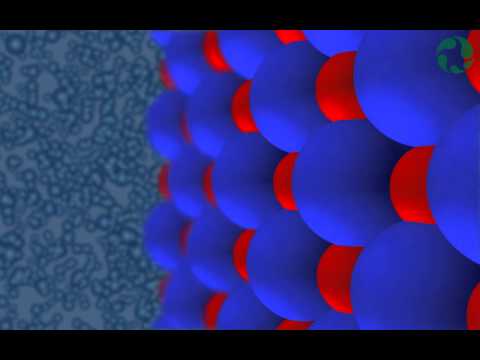
מבנה מולקולרי של מלחים
מלח נקרא מוצק יוני כפי שתואר על ידי המחלקה לכימיה באוניברסיטת פרדו בהסברם על מסיסות. אנרגיה נדרשת כדי לשבור את הקשרים הקוטביים (המגנטיים) החזקים ועל תחליף להחליף את החלקים החסרים בכדי להפריד ביניהם. מולקולות מים מפרידות בין מולקולות המלח ובאותה עת, מולקולות המים נקשרות עם החלקים המופרדים על מנת להפריד ביניהן. תהליך זה יכול להתרחש רק כל עוד יש מולקולות מים. ברגע שהתמיסה מגיעה לשיווי משקל (מולקולות המים נקשרות עם מולקולות מלח רבות ככל שיוכלו לנהל) התהליך נפסק. במהלך הזמן שמתמוסס המלח במים האנרגיה גבוהה והתמיסה מוליכה מאוד.
ממסים ומדד הקוטביות
Chemical-Ecology.net מציעה רשימה של ממסים המציגה מים כבעלי אינדקס קוטביות של תשע. המשמעות היא שזה הפיתרון המאוזן ביותר בכל הקשור לקוטביות שלו, ולכן הוא הפיתרון היחיד שממיס מלח. יש מלחים שאינם מסיסים אפילו במים. האנציקלופדיה העולמית החדשה מסבירה שכמו שמתמוסס לכדי; בעיקרון, מוצקים קוטביים (טעונים מגנטית) מתמוססים לממסים קוטביים ומוצקים שאינם קוטביים (לא טעונים מגנטית) מתמוססים לממסים לא קוטביים. במדד הקוטביות, הממס הקרוב ביותר למים בקטבים הוא דימתיל סולפוקסיד ב 7.2.
מלחים מסיסים
••• Hemera Technologies / AbleStock.com / Getty Imagesמלח שולחן הוא רק סוג אחד של מלח והוא מסיס במים. מלחים מסיסים אחרים במים כוללים חנקות, כלורידים וסולפטים. ישנם יוצאים מן הכלל לכלל. מלח נחשב בלתי מסיס אם, על פי הגדרתו של אוניברסיטת פרדו, הוא יכול להתמוסס בטמפרטורת החדר לריכוז של 0.1 שומן לליטר לכל הפחות. InnovateUs.net מציע ששומות הן יחידת המידה של מסיסות החומר ומחושבות לליטר.
מלחים בלתי מסיסים

חלק מהמלחים אינם מסיסים. על פי הגדרתה של אוניברסיטת פרדו, מלח נחשב בלתי מסיס הוא הריכוז של תמיסת המים (מים) בטמפרטורת החדר אינו עולה על 0.001 שומה בטמפרטורת החדר. המלחים ברשימה זו כוללים סולפידים, תחמוצות, הידרוקסידים, כרומטים ופוספטים. ושוב, ישנם כמה חריגים.