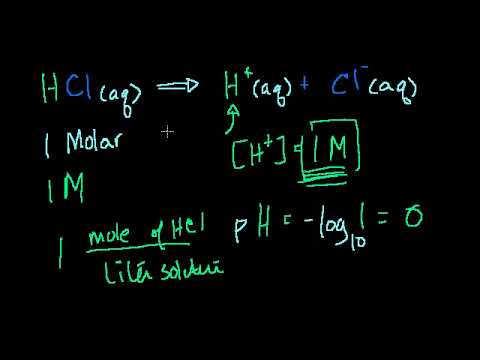
תוֹכֶן
נתרן הידרוקסיד או NaOH הוא תרכובת יונית השייכת לקבוצה של תרכובות הנקראות בסיסים. ידוע גם בשם שומן, הוא מוצא מגוון רחב של שימושים במעבדות כימיה, בתעשייה הכימית ובבנייה, בין יישומים אחרים. ארבע ההשפעות הבאות יכולות להופיע כאשר ריכוז הנתרן הידרוקסיד במים עולה.
יונים של הידרוקסיד
כאשר NaOH מתמוסס למים, הוא מתנתק לשני יונים: יון נתרן טעון חיובי ויון הידרוקסיד טעון שלילי (OH-). המספר המוגבר של יוני ההידרוקסיד בתמיסה מגדיל את ריכוז יוני ההידרוקסיד במים.
pH
מים יכולים לעבור תגובה הנקראת autoprotolysis, לפיה מולקולת מים אחת תורמת פרוטון (יון מימן) לאחר, וכתוצאה מכך נוצרת יון הידרוקסיד (OH-) ויון הידרוניום (H3O +). תגובה זו יכולה להיות גם הפוכה, מכיוון שיוני ההידרוקסיד מקבלים אטום מימן מיוני הידרוניום ליצירת מולקולת מים. במים טהורים תגובה דו כיוונית זו נמצאת בשיווי משקל כך שריכוז יוני ההידרוקסיד וההידרוניום במים שווה. היומן השלילי של ריכוז יון המימן נקרא pH; למים טהורים יש pH של 7. יוני ההידרוקסיד מהנתרן הידרוקסיד המומס פוגעים באיזון זה; ככל שההידרוקסידים הנוספים מקבלים פרוטונים מיוני הידרוניום, הם מורידים את ריכוז יון המימן ובכך מגדילים את ה- pH. הוספת נתרן הידרוקסיד נוספת תעלה את רמת החומציות של המים או תהפוך אותם לבסיסיים יותר.
נטרול
בסיס כמו נתרן הידרוקסיד יכול להגיב עם חומצה כדי לנטרל אותה. בסוג זה של תגובה, יון ההידרוקסיד יקבל פרוטון מהחומצה ליצירת מולקולת מים (H2O). הוספת נתרן הידרוקסיד לתמיסה של חומצה יכולה לנטרל חלק מהחומצה במים.
חוצץ
חוצץ הוא פיתרון המציג שינוי מועט ב- pH כאשר מוסיפים חומצה או בסיס. תמיסה מרוכזת של נתרן הידרוקסיד פועלת כחוצץ (גם אם זה מאוד אלקליין) מכיוון שהוספת כמויות קטנות לא תשנה את החומציות בצורה משמעותית - החומצה תגיב רק עם הנתרן הידרוקסיד שהיה כבר במים, וה- pH יהיה לא ישתנה באופן משמעותי מכיוון שה- pH הוא סולם לוגריתמי.