רוב האנשים מכירים את השימוש במילים לערכים מספריים כמו "תריסר" לשנים עשר ו"זוג "לשניים. הכימיה משתמשת במושג דומה עם החפרפרת (מולקולת mol), המתייחסת לא ליונק קטן שמתחפר אלא למספר 6.022 x 10 לכוח ה -23. המספר מדויק בהרבה מזה, אך עבור מרבית החישובים זה די מדויק. השומה נגזרת ממספר האטומים ב- 12 גרם פחמן -12, השומה מאפשרת להשתמש במשקל המולקולרי של חומר כגורם המרה בין שומות לגרמים של חומר.
כתוב את הנוסחה לחומר עם מספר שומות. נוסחאות כימיות מתארות את מספר האטומים עבור כל יסוד בחומר. לדוגמא, למים יש את הנוסחה H2O המציין כי כל מולקולה מכילה שני אטומי מימן ואטום חמצן. מספר השומות לכל חומר כתוב לפני הנוסחה עם ערכים של שומה אחת שלא נכתבה. שתי שומות מים כתובות כ- 2 H2O ו 1.8 שומות של מים כתוב כ- 1.8 שומן H2O.
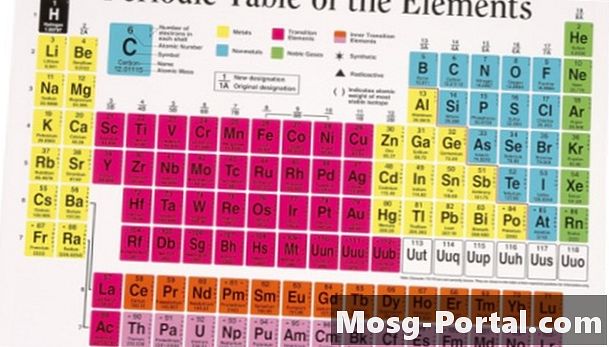
סה"כ את משקלות האטום של כל אטום במולקולה כדי למצוא את המשקל המולקולרי של החומר. משקולות האטום מופיעות בטבלה המחזורית מתחת לסמל עבור כל אחד מהרכיבים. לדוגמא, המשקל המולקולרי של מים נמצא על ידי הוספת משקלי האטום לשני אטומי המימן ואטום חמצן אחד בכל מולקולה. המשקל האטומי של מימן הוא 1.008 והמשקל האטומי של חמצן הוא 16.00, ולכן המשקל המולקולרי הוא 18.02 (1.008 + 1.008 + 16.00 = 18.02).
הכפל את המשקל המולקולרי במספר השומות עבור החומר. המשקל המולקולרי הוא מספר הגרמים לשומה עבור החומר ונותן את גורם ההמרה של שומות לגרמים עבור אותו חומר מסוים. אז, שומה אחת של מים יש מסה של 18.02 גרם (1 mol H2O x 18.02 גרם / mol = 18.02 גרם). לשני שומות מים יש מסה של 36.04 גרם (2 mol H2O x 18.02 גרם / mol = 36.02 גרם). שברים של שומה מחושבים באותה צורה כך של 1.8 mol מים יש מסה של 32.44 גרם (1.8 mol H2O x 18.02 גרם / mol = 32.44 גרם).