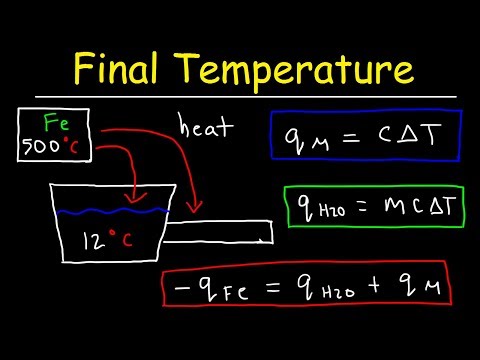
כשיש לך בעיה בכימיה או בפיזיקה שמבקשת ממך לחשב את הטמפרטורה הסופית של חומר, למשל, אתה מפעיל כמות מסוימת של חום על מים בטמפרטורת התחלה מסוימת, אתה יכול למצוא את התשובה באמצעות אחת התרמודינמיות הנפוצות ביותר. משוואות. על פי הגבול בין כימיה ופיזיקה, התרמודינמיקה היא ענף של מדעי הפיזיקה העוסק בהעברות חום ואנרגיה בטבע, והיקום בכללותו.
כתב את משוואת החום הספציפית, Q = mcΔT. האות "Q" היא החום המועבר בחילופי קלוריות, "m" היא המסה של החומר המחומם בגרמים, "c" הוא קיבולת החום הספציפית שלו והערך הסטטי, ו- "ΔT" הוא שינויו ב טמפרטורה במעלות צלזיוס כדי לשקף את שינוי הטמפרטורה. בעזרת חוקי האריתמטיקה, חלק את שני צידי המשוואה ב- "mc" באופן הבא: Q / mc = mcΔT / mc, או Q / mc = ΔT.
חבר את הערכים שבעיית הכימיה שלך נותנת לך למשוואה. אם למשל הוא אומר לך שמישהו מוריד 150 קלוריות חום על 25.0 גרם מים, שיכולת החום הספציפית שלהם, או כמות החום שהוא יכול לעמוד בהם מבלי לחוות שינוי בטמפרטורה, היא 1.0 קלוריות לגרם לכל מעלות צלזיוס, אוכלוס את המשוואה שלך כך: ΔT = Q / mc = 150 / (25) (1) = 150/25 = 6. לכן המים שלך עולים בטמפרטורה ב- 6 מעלות צלזיוס.
הוסף את שינוי הטמפרטורה לטמפרטורות המקוריות שלך לחומרים כדי למצוא את החום הסופי שלה. לדוגמה, אם המים שלך היו בתחילה על 24 מעלות צלזיוס, הטמפרטורה הסופית שלהם תהיה: 24 + 6, או 30 מעלות צלזיוס.